- Номенклатура органічних галогеноідов.
- Фізичні властивості органічних галогеноідов.
- Хімічні властивості органічних галогеноідов.
- Отримання органіческіхз галогенідів.
- Застосування органічних галогеноідов.
Органічні галогеніди (органогалогеніди, галогензамещенние вуглеводні) - клас органічних сполук, які містять атоми галогену Hal, з'єднані з вуглеводневої групою. Цей клас сполук описує формула R-Hal, де R - вуглеводнева група, Hal = F, Cl, Br, I.
Залежно від положення атома Hal в вуглеводневого ланцюга розрізняють первинні, вторинні і третинні органогалогеніди.
У первинних органогалогенідах атом галогену приєднаний до первинного атома С (тобто пов'язаному, крім галогену, тільки з одним вуглецевим атомом: СH3- C H2-Cl, СH3-CH2- C H2- Cl). Первинний атом С виділено жирним шрифтом.
У вторинних органогалогенідах атом галогену приєднаний до вторинного атома С (пов'язаного, крім галогену, з двома вуглецевими атомами: СH3-CH2- C H (Cl) -СH3), вторинний атом С виділено жирним шрифтом.
У теоретичних органогалогенідах атом галогену приєднаний до третинного атому С (жирний шрифт), пов'язаному одночасно з трьома атомами вуглецю: (СH3) 3 С -Cl. Таким чином, атом галогену, відповідно до типу атома С, до якого він приєднаний, також називають первинним, вторинним або третинним.
Залежно від типу органічної групи, пов'язаної з галогеном, розрізняють алкілгалогеніду R-Hal, (де R - насичена або ненасичена аліфатична група) і арілгалогенідов Ar-Hal (Ar - фенільна, нафтільная група і т.п.).
Номенклатура органічних галогеноідов.
Назви органогалогенідов складають у такий спосіб: до назви вуглеводневої групи додають слово «хлорид» (фторид, бромід, йодид), наприклад, СH3-CH2-Cl - Етілхлорід, СH3-CH (Br) -СH3 - ізопропілбромід. У більш складних випадках за основу беруть назву вуглеводню, вуглецевий ланцюг нумерують і потім використовують нумерацію, щоб вказати положення галогену та інших заступників уздовж основної ланцюга. Всі заступники перераховують в алфавітному порядку (рис. 1). Назви, складені за такими правилами, називають систематичними.
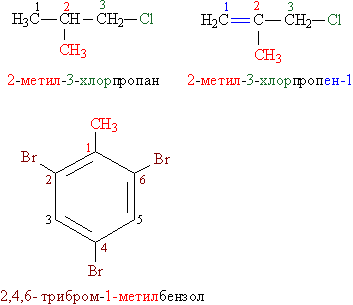
Мал. 1. СИСТЕМАТИЧНІ НАЗВИ алкіл- І арілгалогенідов. Заміщають групи і відповідні їм цифрові індекси виділені розрізняються квітами.
Якщо все атоми Н в вуглеводні заміщені атомами галогену, то до назви з'єднання додають приставку «пер», наприклад, Cl3C-CCl3 - перхлоретан. Для деяких галогенвуглеводні широко використовують історично склалися тривіальні назви ( см. Тривіальні назви РЕЧОВИН ): HCCl3 -хлороформ (систематичне назва тріхлорметан), CH2 = CH-Cl - вінілхлорид (систематичне назва Хлоретилу).
Фізичні властивості органічних галогеноідов.
Фторсодержащие алкілгалогеніду, як правило, газоподібні, хлор, бром і йодовмісні - безбарвні рухливі рідини (на світлі йодовмісні сполуки набувають коричневого забарвлення через часткове розкладання). Температури кипіння алкилгалогенидов збільшуються в напрямку від фтору до йоду, і з ростом числа атомів галогену в з'єднанні. Арілгалогенідов - висококиплячі рідини. Органічні нітрати необмежено змішуються з більшістю органічних розчинників і практично не змішуються з водою.
Хімічні властивості органічних галогеноідов.
Реакції органогалогенідов мають деякі загальні закономірності: їх реакційна здатність зростає в ряду RCl RI, тому алкілйодіди (як найбільш хімічно активні) використовуються для різних лабораторних синтезів, а в промислових процесах широко застосовуються алкілхлоріди, тому що хлор більш поширений в природі і отримання, а також використання хлорпроізводних економічно доцільніше. Хімічна активність галогену в RHal знижується при збільшенні розміру органічної групи R, а також при переході від первинних органогалогенідов до вторинних.
Реакційна здатність органогалогенідов визначається тим, що в угрупованні С-Cl негативний заряд у хлору більше, ніж у атома С, тому на атомі хлору виникає частковий негативний заряд d -, а на атомі С - позитивний заряд d +, це називають поляризацією зв'язку - виникають як би полюса (рис. 2, перший фрагмент). Реагенти, що несуть негативний заряд (аніони), рухаються до позитивного полюса молекули (до атому С, рис. 2, другий фрагмент). За допомогою пари електронів, що поставляється аніоном, утворюється нова зв'язок О-С. Виникає перехідний комплекс (проміжне з'єднання), в якому атом С має п'ять хімічних зв'язків (рис. 2, третій фрагмент). Такий комплекс нестійкий і розпадається, отщепляя аніон Cl-, який забирає з собою пару електронів і негативний заряд.
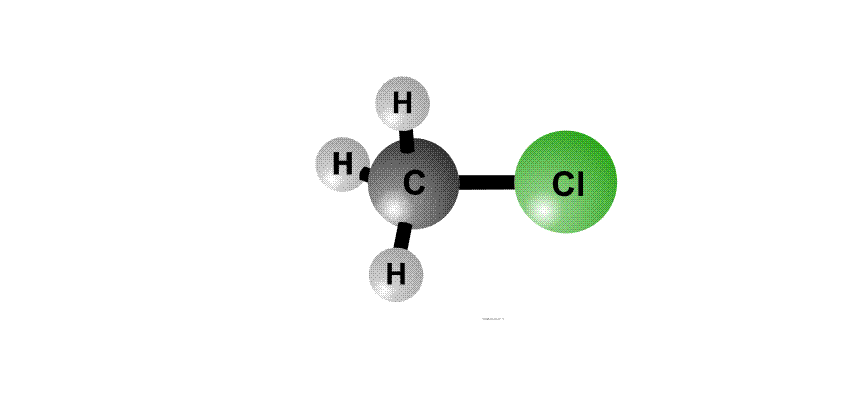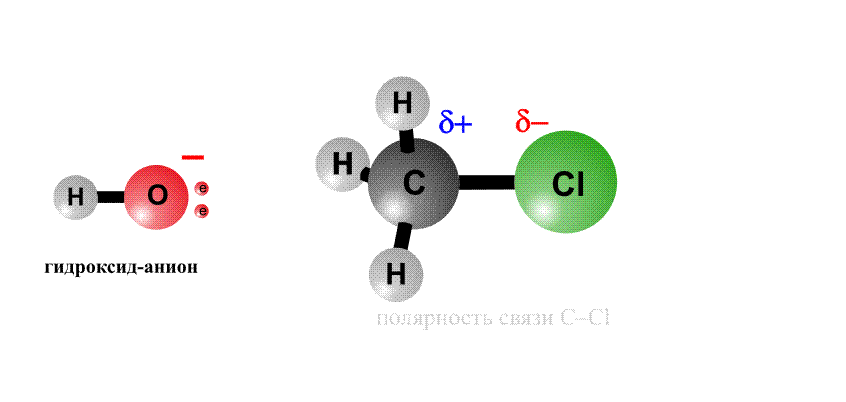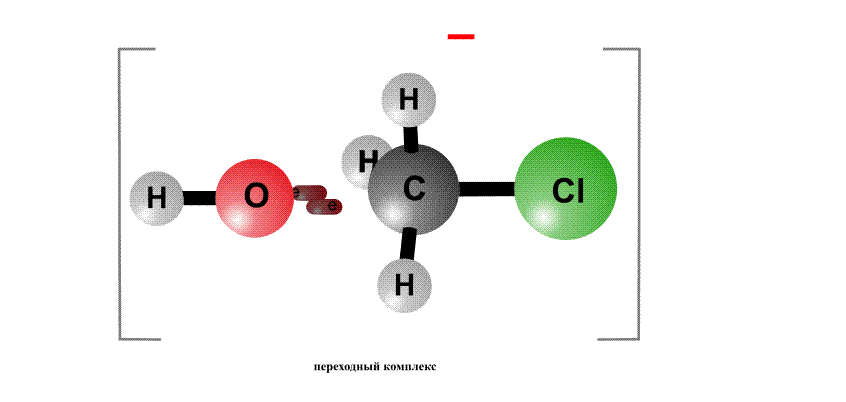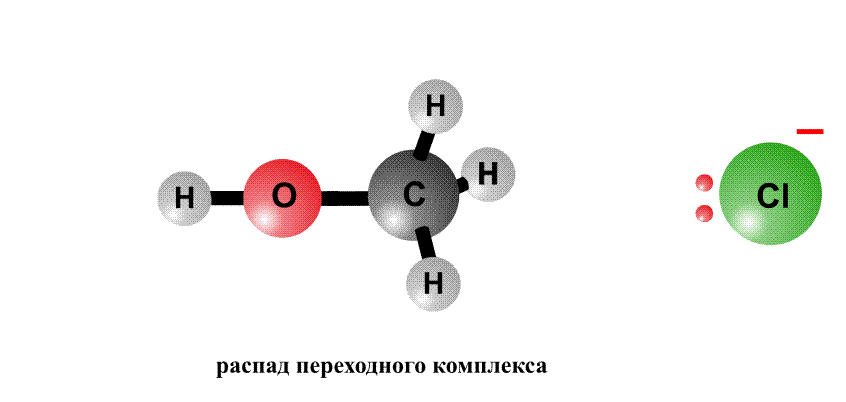
Анион НО, що несе негативний заряд, наближається до молекули алкілхлоріда з того боку, де зосереджений частковий позитивний заряд. Утворюється зв'язок О-С. Виниклий перехідний комплекс з атомом С, що містить п'ять хімічних зв'язків, нестабільний і розпадається, зв'язок C-Cl розривається, і аніон Cl- забирає з собою пару електронів і негативний заряд.
Процеси, коли заміщає група (ОН) наближається до реагенту не з того боку, де розташована йде група (Cl), часто зустрічаються в органічній хімії ( см. ВАЛЬДЕНОВСКАЯ ПЕРЕГРУПУВАННЯ ).
Схема (рис. 2) «не працює», коли атом галогену приєднаний до атому С, який бере участь в утворенні подвійного зв'язку (вінілхлорид CH2 = CH-Cl), або безпосередньо приєднаний до ароматичного ядра (хлорбензол C6H5Cl). Кратна зв'язок і ароматична група відтягують на себе електрони, в результаті поляризація зв'язку C-Cl помітно знижується і з'єднання стає неактивним. Якщо «відсунути» атом Hal від подвійного зв'язку або ароматичного ядра за допомогою проміжної групи CH2, то активність Hal різко зростає, наприклад, в аллілхлоріде CH2 = CH-CH2Cl або бензілхлоріде C6H5CH2Cl. Через CH2-групу вплив кратного зв'язку і ароматичної групи не передається.
У відповідності зі схемою (рис. 2) алкілгалогеніду реагують з різноманітними аніонами, ці реакції показані не в іонної формі, а у вигляді сумарного рівняння реакції. Від алкилгалогенидов ведуть шляхи практично до всіх великих класів органічних сполук. При взаємодії з водними розчинами розбавлених лугів алкілгалогеніду утворюють спирти:
Н3C-Cl + NaOH = Н3C-OH + NaCl
Розчини концентрованих лугів отщепляют від алкілгалогеніду HCl, що призводить до утворення подвійного зв'язку:
Н3C-СН2-Cl + NaOH ® Н2C = СН2 + NaCl + Н2О
Реакція з алкоголятами лужних металів призводить до простих ефірів:
Н3C-Cl + NaOR ® Н3C-OR + NaCl
З солей карбонових кислот утворюються складні ефіри
Н3C-Cl + NaOC (O) R ® Н3C- OC (O) R + NaCl
Виходячи з ціанідів, отримують нітрили - з'єднання з фрагментом C-C є N:
Н3C-Cl + NaC є N ® Н3C-C є N + NaCl
Кислі сульфіди (солі сірководневої кислоти) призводять до утворення тиолов, званих Тіоспирти, оскільки вони представляють собою S-містять аналоги спиртів ne (S замість О):
Н3C-Cl + KSH ® Н3C-SH + KCl
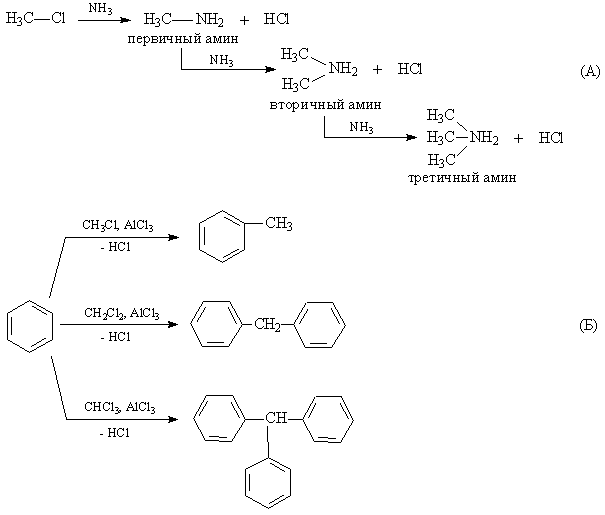
Взаємодія з аміаком супроводжується утворенням первинних амінів , А в результаті послідовних заміщень - вторинних і третинних амінів (рис. 3А).
Алкілгалогеніду використовують і як алкілуючі агенти (в з'єднання вводиться алкильная група). У присутності каталізатора AlCl3 бензол алкілуючі, якщо ж в молекулі алкілхлоріда є два або більше атома Hal, то він виступає в ролі центру, що об'єднує кілька бензольних кілець (рис. 3Б).
Два атома Hal, розташовані у сусідніх вуглецевих атомів, відкривають додаткові можливості для синтезу. При дії металевого Zn на такі сполуки в спиртовому середовищі утворюються подвійні або потрійні зв'язки (в залежності від кількості Hal в молекулі):
BrCH2-CH2Br + Zn ® CH2 = CH2 + ZnBr2
Br2CH-CHBr2 + Zn ® CH є CH + ZnBr2
Якщо атоми Hal приєднані до віддалених атомам С, то цикл замикається:
BrCH2-CH2- CH2-CH2Br + Zn ® CH2-CH2- CH2-CH2 + ZnBr2
На відміну від цинку металевий натрій може взаємодіяти і з сполуками, що містять тільки один Hal, при цьому він здвоює органічні групи (реакція Вюрца ). Якщо в реакції беруть участь різні алкілгалогеніду, то здвоюються як однакові, так і різні групи R:
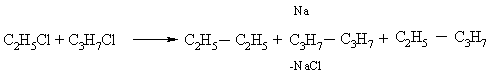
Отримання органіческіхз галогенідів.
Пряме галогенирование вуглеводнів як аліфатичних, так і ароматичних зазвичай призводить до суміші продуктів з різним ступенем галогенування:
C Н4 + Cl2 ® C Н3Cl + C Н2Cl2 + CНCl3
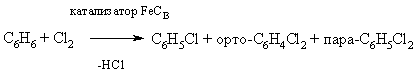
Йодувати таким способом вуглеводні не вдається, зате йод виявляється кращим при іншому способі отримання галогенвуглеводні - приєднанням HHal до подвійного зв'язку в олефіни, при цьому найбільш легко приєднується HI. Такий спосіб, званий зазвичай гідрогалогенірованіе, на відміну від попереднього, дозволяє отримувати не суміш продуктів, а з'єднання з абонентом. Відповідно до правила Марковникова галоген приєднується до того атома С, який пов'язаний з меншим числом атомів Н:
Н3C-СН = СН2 + HBr ® Н3C-СНBr-СН3
Приєднуватися до подвійного зв'язку можуть не тільки галогенвуглеводні, а й самі галогеналкіли, так отримують перхлорірованние (повністю хлоровані) вуглеводні:
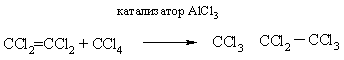
Потрійна зв'язок може приєднувати галогенвуглеводні, в промисловості гідрохлорування ацетилену синтезують вінілхлорид:
СН є СН + HCl ® СН 2 = СНCl
Широко використовується полімер полівінілхлорид (ПВХ) отримують полімеризацією вінілхлориду.
Взаємодія спиртів галогеноводородами також призводить до галогеналкіли, це рівноважний процес (можливий як прямий, так і зворотний процеси, позначено здвоєними стрілками), щоб зрушити реакцію в потрібному напрямку, з реакційного середовища видаляють утворюється воду, пов'язуючи її з допомогою сірчаної кислоти або ZnCl2:
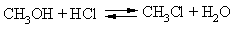
ОН-групу в спиртах можна замінити галогеном за допомогою галогенідів фосфору, в залежності від природи пов'язаного з фосфором галогену отримують відповідно хлор, бром або йодалкіли:
С2Н5ОН + PCl5 ® С2Н5Cl + PОCl3 + НCl
2С2Н5ОН + PI3 ® 2 С2Н5I + HPО2 + НCl
Застосування органічних галогеноідов.
Здатність органогалогенідов розчиняти жири і масла визначила їх застосування в якості засобів для знежирення металевих поверхонь.
Тетрахлоретилен ССl2 = ССl2 використовують в установках для чищення одягу (хімічне чищення).
Фторхлорзамещенние метану і етани CHC1F2, CF2C1-CF2C1 - негорючі речовини, газоподібні при кімнатній температурі, легко зріджується під тиском, це дозволяє використовувати їх для заповнення балонів, в які попередньо поміщені різні побутові препарати - косметичні засоби, лікарські речовини, інсектициди й фарби (аерозольна упаковка).
З'єднання подібного складу CF2C12 і CHF2C1 (торгові назви фреони і хладони) застосовують як холодоагенти, це речовини, які при кипінні або в процесі розширення віднімають теплоту від охолоджуваного об'єкта і потім після стиснення передають її охолоджуючої середовищі - воді або повітрю. Холодоагенти - «робочі речовини» в холодильних установках.
Фторхлорзамещенние метану і етани використовують також як спінюючої агенти при виробництві пінопластів.
Тріфторбромметан CF3Br і тетрафтордіброметан C2F4Br2 - легкокипящие негорючі рідини з дуже високою щільністю парів, їх використовують для заповнення вогнегасників особливого типу, використання яких не вимагає присутності людини. Балон, що містить таку речовину, з попередньо відкритим вентилем швидко поміщають в палаюче приміщення і щільно закривають двері. Пари галогенвуглеводні, поступово заповнюють всі приміщення, починаючи від статі, витісняють повітря і зупиняють горіння.
Вінілхлорид СН2 = СНCl - мономер, при полімеризації якого отримують широко поширений полімер полівінілхлорид (ПВХ), який використовується для створення плівкових матеріалів, в якості електроізоляції проводів і кабелів, в побуті він відомий як матеріал для виготовлення лінолеуму і штучної шкіри.
Полімеризацією тетрафторетилену CF2 = CF2 отримують політетрафторетилен (фторопласт, тефлон), що володіє незвичайним поєднанням експлуатаційних властивостей: механічною міцністю, високими діелектричними параметрами, виняткову хімічну стійкість, низьким коефіцієнтом тертя, а також широкої областю робочих температур (від -260 до +260 ° С) . З фторопласта виготовляють плівки, волокна, шланги, електроізоляцію для проводів і кабелів, хімічні реактори, контейнери для агресивних рідин, що труться деталі, які не потребують змащення, і навіть протези органів людини.
Михайло Левицький


 С сентября 2006 года серийно выпускается БМВ 3-й серии купе (Е92). Невзирая на свое техническое родство с седаном и Touring, купе БМВ 3-й серии имеет
С сентября 2006 года серийно выпускается БМВ 3-й серии купе (Е92). Невзирая на свое техническое родство с седаном и Touring, купе БМВ 3-й серии имеет
 Аш длительный тест Range Rover Sport Supercharged подошел к концу. Первая хорошая новость: машину не угнали! Вторая: несмотря на соблазн, за
Аш длительный тест Range Rover Sport Supercharged подошел к концу. Первая хорошая новость: машину не угнали! Вторая: несмотря на соблазн, за
 Audi E-tron, представленный на автосалоне в Детройте в январе 2010 года, совсем не то же самое, что E-tron, который выставлялся осенью на IAA 2009 во
Audi E-tron, представленный на автосалоне в Детройте в январе 2010 года, совсем не то же самое, что E-tron, который выставлялся осенью на IAA 2009 во
 В зимнее время года при морозной погоде аккумулятор автомобиля испытывает нагрузку намного больше, чем в летнее время. Автовладельцами замеченны
В зимнее время года при морозной погоде аккумулятор автомобиля испытывает нагрузку намного больше, чем в летнее время. Автовладельцами замеченны
 Эта модель расширяет присутствие компании SEAT в сегменте рынка престижных автомобилей. Toledo - первый автомобиль компании дизайн которого выполнен
Эта модель расширяет присутствие компании SEAT в сегменте рынка престижных автомобилей. Toledo - первый автомобиль компании дизайн которого выполнен
 В 2000 г. семейство японских Corolla лишь обновилось. Спрос на эти машины падал и классическая Corolla уже не устраивала японских покупателей. Как
В 2000 г. семейство японских Corolla лишь обновилось. Спрос на эти машины падал и классическая Corolla уже не устраивала японских покупателей. Как
 Skoda Octavia - это современный переднеприводной автомобиль с поперечным расположением двигателя. На нём может стоять один из пяти моторов концерна
Skoda Octavia - это современный переднеприводной автомобиль с поперечным расположением двигателя. На нём может стоять один из пяти моторов концерна
 Дебют серийной модели PT Cruiser состоялся в 1999 году в Детройте. Компании Chrysler удалось зацепить ностальгическую струну в душе каждого простого
Дебют серийной модели PT Cruiser состоялся в 1999 году в Детройте. Компании Chrysler удалось зацепить ностальгическую струну в душе каждого простого
 Компания сыграла на контрасте, представив одновременно две модели, совершенно противоположные по идеологии: сверхэкономичный лимузин-гибрид А8 и
Компания сыграла на контрасте, представив одновременно две модели, совершенно противоположные по идеологии: сверхэкономичный лимузин-гибрид А8 и
 Toyota Tundra (Тойота Тундра) проектировался как грузовик. Мощный двигатель, основательная рама и большая грузоподъемность... вот что отличает этот
Toyota Tundra (Тойота Тундра) проектировался как грузовик. Мощный двигатель, основательная рама и большая грузоподъемность... вот что отличает этот

