Молекул я рние сп е ктри, оптичні спектри випускання і поглинання, а також комбінаційного розсіювання світла , Що належать вільним або слабо зв'язаним між собою молекулам . М. с. мають складну структуру. Типові М. с. - смугасті, вони спостерігаються в випущенні і поглинанні і в комбінаційному розсіянні в вигляді сукупності більш-менш вузьких смуг в ультрафіолетовій, видимій і близькій інфрачервоній областях, що розпадаються при достатньою роздільною силі застосовуваних спектральних приладів на сукупність тісно розташованих ліній. Конкретна структура М. с. різна для різних молекул і, взагалі кажучи, ускладнюється зі збільшенням числа атомів в молекулі. Для дуже складних молекул видимі і ультрафіолетові спектри складаються з небагатьох широких суцільних смуг; спектри таких молекул схожі між собою.
М. с. виникають при квантових переходах між рівнями енергії E 'і E' 'молекул згідно із співвідношенням
h n = E '- E' ', (1)
де h n - енергія випускається поглинається фотона частоти n (h - планка постійна ). При комбінаційному розсіянні h n дорівнює різниці енергій падаючого і розсіяного фотонів. М. с. набагато складніше лінійчатих атомних спектрів, що визначається більшою складністю внутрішніх рухів в молекулі, ніж в атомах. Поряд з рухом електронів відносно двох або більше ядер в молекулах відбуваються коливальний рух ядер (разом з оточуючими їх внутрішніми електронами) близько положень рівноваги і обертальний рух молекули як цілого. Цим трьом видам рухів - електронному, коливального та обертального - відповідають три типи рівнів енергії і три типи спектрів.
Згідно з квантовою механікою, енергія всіх видів руху в молекулі може приймати лише певні значення, т. Е. Вона квантуется. Повна енергія молекули E приблизно може бути представлена у вигляді суми квантованих значень енергій трьох видів її руху:
E = E ел + E кіл + E оберт. (2)
Один по одному величин
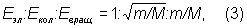
де m - маса електрона, а величина М має порядок маси ядер атомів в молекулі, т. е. m / М ~ 10-3-10-5, отже:
E ел >> E кіл >> E оберт. (4)
Зазвичай E ел порядку декількох ев (декілька сотень кдж / моль), E кол ~ 10-2-10-1 ев, E вращ ~ 10-5-10-3 ев.
Відповідно до (4) система рівнів енергії молекули характеризується сукупністю далеко віддалених один від одного електронних рівнів (різні значення E ел при E кіл = E вращ = 0), значно ближче один до одного розташованих коливальних рівнів (різні значення E кіл при заданому E л і E вращ = 0) і ще більш близько розташованих обертальних рівнів (різні значення E вращ при заданих E ел і E кіл). На рис. 1 приведена схема рівнів двоатомних молекули; для багатоатомних молекул система рівнів ще більш ускладнюється.
Електронні рівні енергії (E ел в (2) і на схемі рис. 1 відповідають рівноважним конфігурацій молекули (в разі двоатомних молекули характеризується рівноважним значенням r 0 меж'ядерного відстані r, див. Рис. 1 в ст. молекула ). Кожному електронному стану відповідають певна рівноважна конфігурація і певне значення E ел; найменше значення відповідає основному рівню енергії.
Набір електронних станів молекули визначається властивостями її електронної оболонки. В принципі значення E ел можна розрахувати методами квантової хімії , Проте дана задача може бути вирішена тільки за допомогою наближених методів і для порівняно простих молекул. Найважливішу інформацію про електронні рівнях молекули (розташування електронних рівнів енергії і їх характеристики), яка визначається її хімічною будовою, отримують, вивчаючи її М. с.
Вельми важлива характеристика заданого електронного рівня енергії - значення квантового числа S, що характеризує абсолютну величину повного спінового моменту всіх електронів молекули. Хімічно стійкі молекули мають, як правило, парне число електронів, і для них S = 0, 1, 2 ... (для основного електронного рівня типово значення S = 0, а для збуджених - S = 0 і S = 1). Рівні з S = 0 називаються синглетними, з S = 1 - триплетними (т. К. Взаємодія в молекулі приводить до їх розщеплення на c = 2 S + 1 = 3 підрівні; см. Мультиплетність ). радикали вільні мають, як правило, непарне число електронів, для них S = 1/2, 3/2, ... і типово як для основного, так і для збуджених рівнів значення S = 1/2 (дублетні рівні, що розщеплюються на c = 2 підрівні).
Для молекул, рівноважна конфігурація яких володіє симетрією, електронні рівні можна додатково класифікувати. У разі двоатомних і лінійних триатомним молекул, що мають вісь симетрії (нескінченного порядку), що проходить через ядра всіх атомів (див. Рис. 2, б), електронні рівні характеризуються значеннями квантового числа l, що визначає абсолютну величину проекції повного орбітального моменту всіх електронів на вісь молекули. Рівні з l = 0, 1, 2, ... позначаються відповідно S, П, D ..., а величина c вказується індексом зліва вгорі (наприклад, 3 S, 2 p, ...). Для молекул, що володіють центром симетрії, наприклад CO2 і C6H6 (див. Рис. 2, б, в), всі електронні рівні діляться на парні і непарні, що позначаються індексами g і u (в залежності від того, чи зберігає хвилева функція знак при зверненні в центрі симетрії або міняє його).
Коливальні рівні енергії (значення Е кіл) можна знайти квантуванням коливального руху, яке наближено вважають гармонійним. У найпростішому випадку двоатомних молекули (одна коливальна ступінь свободи, відповідна зміні меж'ядерного відстані r) її розглядають як гармонійний осцилятор ; його квантування дає рівновіддалені рівні енергії:
E кіл = h ne (u +1/2), (5)
де ne - основна частота гармонійних коливань молекули, u - коливальний квантове число, що набуває значень 0, 1, 2, ... На рис. 1 показані коливальні рівні для двох електронних станів.
Для кожного електронного стану багатоатомної молекули, що складається з N атомів (N ³ 3) і має f коливальних ступенів свободи (f = 3 N - 5 і f = 3 N - 6 для лінійних і нелінійних молекул відповідно), виходить f т. Н. нормальних коливань з частотами ni (i = 1, 2, 3, ..., f) і складна система коливальних рівнів:
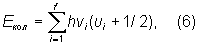
де u i = 0, 1, 2, ... - відповідні коливальні квантові числа. Набір частот нормальних коливань в основному електронному стані є дуже важливою характеристикою молекули, що залежить від її хімічної будови. У певному нормальному коливанні беруть участь всі атоми молекули або частина їх; атоми при цьому здійснюють гармонійні коливання з однією частотою v i, але з різними амплітудами, що визначають форму коливання. Нормальні коливання поділяють на їхню формі на валентні (при яких змінюються довжини ліній зв'язку) і деформаційні (при яких змінюються кути між хімічними зв'язками - валентні кути). Число різних частот коливань для молекул низької симетрії (що не мають осей симетрії порядки вище 2) дорівнює 2, і все коливання є невиродженими, а для більш симетричних молекул є двічі і тричі вироджені коливання (пари і трійки співпадаючих по частоті коливань). Наприклад, у нелінійній трьохатомної молекули H2O (рис. 2, а) f = 3 і можливі три невироджених коливання (два валентних і одне деформаційне). Більш симетрична лінійна трьохатомна молекула CO2 (рис. 2, б) має f = 4 - два невироджених коливання (валентних) і одне двічі вироджені (деформаційне). Для плоскої високосімметрічной молекули C6H6 (рис. 2, в) виходить f = 30 - десять невироджених і 10 двічі вироджених коливань; з них 14 коливань відбуваються в площині молекули (8 валентних і 6 деформаційних) і 6 неплоских деформаційних коливань - перпендикулярно цій площині. Ще більш симетрична тетраедричних молекула CH4 (рис. 2, г) має f = 9 - одне невироджене коливання (валентное), одне двічі вироджені (деформаційне) і два тричі вироджених (одне валентное і одне деформаційне).
Обертальні рівні енергії можна знайти квантуванням обертального руху молекули, розглядаючи її як тверде тіло з певними моментами інерції . У найпростішому випадку двухатомной або лінійної багатоатомної молекули її енергія обертання
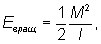
де I - момент інерції молекули відносно осі, перпендикулярної осі молекули, а М - обертальний момент кількості руху. Згідно з правилами квантування,
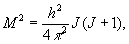
де обертальний квантове число J = 0, 1, 2, ..., і, отже, для E вращ отримали:
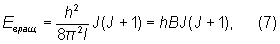
де обертальна постійна 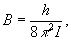 визначає масштаб відстаней між рівнями енергії, що зменшується зі збільшенням мас ядер і меж'ядерних відстаней. На рис. 1 показані обертальні рівні для кожного електронно-коливального стану.
визначає масштаб відстаней між рівнями енергії, що зменшується зі збільшенням мас ядер і меж'ядерних відстаней. На рис. 1 показані обертальні рівні для кожного електронно-коливального стану.
Різні типи М. с. виникають при різних типах переходів між рівнями енергії молекул. Згідно (1) і (2)
D E = E '- E' '= D E ел + D E кіл + D E вращ, (8)
де зміни D E ел, D E кіл і D E вращ електронної, коливальної та обертальної енергій задовольняють умові:
D E ел >> D E кіл >> D E вращ (9)
[відстані між рівнями того ж порядку, що і самі енергії E ел, E ол і E вращ, що задовольняють умові (4)].
При D E ел ¹ 0 виходять електронні М. с., Спостережувані у видимій і в ультрафіолетовій (УФ) областях. Зазвичай при D E ел ¹ 0 одночасно D E кіл ¹ 0 і D E вращ ¹ 0; різним D E кіл при заданому D E ел відповідають різні коливальні смуги (рис. 3), а різним D E вращ при заданих D E ел і D E кіл - окремі обертальні лінії, на які розпадається дана смуга; виходить характерна смугаста структура (рис. 4). Сукупність смуг із заданим D E ел (відповідним чисто електронному переходу з частотою v ел = D E ел / h) звана системою смуг; окремі смуги володіють різною інтенсивністю в залежності від відносних ймовірностей переходів (див. квантові переходи ), Які можуть бути приблизно розраховані квантовомеханічними методами. Для складних молекул смуги однієї системи, відповідні даному електронному переходу, зазвичай зливаються в одну широку суцільну смугу, можуть накладатися один на одного і кілька таких широких смуг. Характерні дискретні електронні спектри спостерігаються в заморожених розчинах органічних сполук (див. Шпольського ефект ). Електронні (точніше, електронно-коливально-обертальні) спектри вивчаються експериментально за допомогою спектрографів і спектрометрів із скляною (для видимої області) і кварцовою (для УФ-області) оптикою, в яких для розкладання світла в спектр застосовуються призми або дифракційні грати (див. спектральні прилади ).
При D E ел = 0, а D E кіл ¹ 0 виходять коливальні М. с., Спостережувані в близькій (до декількох мкм) і в середній (до декількох десятків мкм) інфрачервоної (ІК) області, зазвичай в поглинанні, а також в комбінаційному розсіянні світла. Як правило, одночасно D E вращ ¹ 0 і при заданому E кіл виходить коливальна смуга, що розпадається на окремі обертальні лінії. Найбільш інтенсивні в коливальних М. с. смуги, відповідні D u = u '- u' '= 1 (для багатоатомних молекул - D u i = u i' - u i '' = 1 при D u k = u k '- u k' '= 0, де k ¹ i).
Для чисто гармонійних коливань ці відбору правила , Що забороняють ін. Переходи, виконуються строго; для ангармонічні коливань з'являються смуги, для яких D u> 1 (обертони); їх інтенсивність зазвичай мала і убуває зі збільшенням D u.
Коливальні (точніше, колебательно-обертальні) спектри вивчаються експериментально в ІК-області в поглинанні за допомогою ІК-спектрометрів з призмами, прозорими для ІК-випромінювання, або з дифракційними гратами, а також Фур'є-спектрометрів і в комбінаційному розсіянні за допомогою светосильних спектрографів ( для видимої області) із застосуванням лазерного збудження.
При D E ел = 0 і D E кіл = 0 виходять чисто обертальні М. с., Що складаються з окремих ліній. Вони спостерігаються в поглинанні в далекій (сотні мкм) ІК-області і особливо в мікрохвильовій області, а також в спектрах комбінаційного розсіювання. Для двоатомних і лінійних багатоатомних молекул (а також для досить симетричних нелінійних багатоатомних молекул) ці лінії одно відстоять (в шкалі частот) один від одного з інтервалами D n = 2 B в спектрах поглинання і D n = 4 B в спектрах комбінаційного розсіювання.
Чисто обертальні спектри вивчають в поглинанні в далекій ІЧ-області за допомогою ІК-спектрометрів із спеціальними дифракційними гратами (ешелет) і Фур'є-спектрометрів, в мікрохвильової області за допомогою мікрохвильових (СВЧ) спектрометрів (див. мікрохвильова спектроскопія ), А також в комбінаційному розсіянні за допомогою светосильних спектрографів.
Методи молекулярної спектроскопії, засновані на вивченні М. с., Дозволяють вирішувати різноманітні завдання хімії, біології та ін. Наук (наприклад, визначати склад нафтопродуктів, полімерних речовин і т. П.). У хімії по М. с. вивчають структуру молекул. Електронні М. с. дають можливість отримувати інформацію про електронні оболонках молекул, визначати збуджені рівні і їх характеристики, знаходити енергії дисоціації молекул (по сходженню коливальних рівнів молекули до кордонів дисоціації). Дослідження коливальних М. с. дозволяє знаходити характеристичні частоти коливань, відповідні певним типам хімічних зв'язків в молекулі (наприклад, простих подвійних і потрійних зв'язків С-С, зв'язків С-Н, N-Н, О-Н для органічних молекул), різних груп атомів (наприклад, CH2, CH3, NH2), визначати просторову структуру молекул, розрізняти цис- і транс-ізомери. Для цього застосовують як інфрачервоні спектри поглинання (ІКС), так і спектри комбінаційного розсіювання (СКР). Особливо широке поширення отримав метод ІКС як один з найефективніших оптичних методів вивчення будови молекул. Найбільш повну інформацію він дає в поєднанні з методом СКР. Дослідження обертальних М. с., А також обертальної структури електронних і коливальних спектрів дозволяє по знайденим з досвіду значенням моментів інерції молекул [які виходять із значень обертальних постійних, см. (7)] знаходити з великою точністю (для простіших молекул, наприклад H2O ) параметри рівноважної конфігурації молекули - довжини зв'язків і валентні кути. Для збільшення числа визначених параметрів досліджують спектри изотопических молекул (зокрема, в яких водень замінений дейтерієм), що мають однакові параметри рівноважних конфігурацій, але різні моменти інерції.
Як приклад застосування М. с. для визначення хімічної будови молекул розглянемо молекулу бензолу C6H6. Вивчення її М. с. підтверджує правильність моделі, згідно з якою молекула плоска, а все 6 зв'язків С-С в бензольному кільці рівноцінні і утворюють правильний шестикутник (рис. 2, б), що має вісь симетрії шостого порядку, що проходить через центр симетрії молекули перпендикулярно її площині. Електронний М. с. поглинання C6H6 складається з декількох систем смуг, що відповідають переходам з основного парного синглетного рівня на збуджені непарні рівні, у тому числі перший є тріплетним, а більш високі - синглетними (рис. 5). Найбільш інтенсивна система смуг в області 1840  (E 5 - E 1 = 7,0 ев), найбільш слабка система смуг в області 3400
(E 5 - E 1 = 7,0 ев), найбільш слабка система смуг в області 3400  (E 2 - E 1 = 3,8 ев), відповідна синглетно-триплетному переходу, забороненого наближеними правилами відбору для повного спина. Переходи відповідають збудженню т. Н. p-електронів, делокалізованних по всьому бензольного кільця (див. молекула ); отримана з електронних молекулярних спектрів схема рівнів рис. 5 знаходиться в згоді з наближеними квантовомеханічними розрахунками. Коливальні М. с. C6H6 відповідають наявності в молекулі центру симетрії - частоти коливань, які проявляються (активні) в ІКС, відсутні (неактивні) в СКР і навпаки (т. Н. Альтернативний заборона). З 20 нормальних коливань C6H6 4 активні в ІКС і 7 активні в СКР, інші 11 неактивні як в ІКС, так і в СКР. Значення вимірюваних частот (в см-1): 673, 1038, 1486, 3080 (в ІКС) і 607, 850, 992, 1178, +1596, +3047, +3062 (в СКР). Частоти 673 і 850 відповідають неплоским коливань, все решта частоти - плоским коливанням. Особливо характерні для плоских коливань частота 992 (відповідна валентному коливанню зв'язків С-С, що складається в періодичному стискуванні і розтягуванні бензольного кільця), частоти 3062 і 3080 (відповідні валентним коливанням зв'язків С-Н) і частота 607 (відповідна деформаційному коливання бензольного кільця). Спостережувані коливальні спектри C6H6 (і аналогічні їм коливальні спектри C6D6) знаходяться в дуже хорошому злагоді з теоретичними розрахунками, що дозволили дати повну інтерпретацію цих спектрів і знайти форми всіх нормальних коливань.
(E 2 - E 1 = 3,8 ев), відповідна синглетно-триплетному переходу, забороненого наближеними правилами відбору для повного спина. Переходи відповідають збудженню т. Н. p-електронів, делокалізованних по всьому бензольного кільця (див. молекула ); отримана з електронних молекулярних спектрів схема рівнів рис. 5 знаходиться в згоді з наближеними квантовомеханічними розрахунками. Коливальні М. с. C6H6 відповідають наявності в молекулі центру симетрії - частоти коливань, які проявляються (активні) в ІКС, відсутні (неактивні) в СКР і навпаки (т. Н. Альтернативний заборона). З 20 нормальних коливань C6H6 4 активні в ІКС і 7 активні в СКР, інші 11 неактивні як в ІКС, так і в СКР. Значення вимірюваних частот (в см-1): 673, 1038, 1486, 3080 (в ІКС) і 607, 850, 992, 1178, +1596, +3047, +3062 (в СКР). Частоти 673 і 850 відповідають неплоским коливань, все решта частоти - плоским коливанням. Особливо характерні для плоских коливань частота 992 (відповідна валентному коливанню зв'язків С-С, що складається в періодичному стискуванні і розтягуванні бензольного кільця), частоти 3062 і 3080 (відповідні валентним коливанням зв'язків С-Н) і частота 607 (відповідна деформаційному коливання бензольного кільця). Спостережувані коливальні спектри C6H6 (і аналогічні їм коливальні спектри C6D6) знаходяться в дуже хорошому злагоді з теоретичними розрахунками, що дозволили дати повну інтерпретацію цих спектрів і знайти форми всіх нормальних коливань.
Подібним же чином можна за допомогою М. с. визначати структуру різноманітних класів органічних і неорганічних молекул, аж до дуже складних, наприклад молекул полімерів.
Літ .: Кондратьєв В. Н., Структура атомів і молекул, 2 вид., М., 1959; Ельяшевич М. А., Атомна і молекулярна спектроскопія, М., 1962; Герцберг Г., Спектри і будова двоатомних молекул, пер. з англ., М., 1949; його ж, Коливальні і обертальні спектри багатоатомних молекул, пер. з англ., М., 1949; його ж, Електронні спектри і будова багатоатомних молекул, пер. з англ., М., 1969; Застосування спектроскопії в хімії, під ред. В. Веста, пров. з англ., М., 1959.
М. А. Ельяшевич.

Мал. 4. Обертальне розщеплювання електронно-колівальної Смуги 3805  молекули N2.
молекули N2.

Мал. 1. Схема рівнів енергії двоатомних молекули: а і б - електронні рівні; v 'і v' '- квантові числа коливальних рівнів. J 'і J' '- квантові числа обертальних рівнів.

Мал. 5. Схема електронних рівнів і переходів для молекули бензолу. Енергія рівнів дана в ев. З - синглетні рівні; Т - триплетний рівень. Парність рівня вказана літерами g і u. Для систем смуг поглинання вказані приблизні області довжин хвиль в  , Більш інтенсивні системи смуг позначені більш жирними стрілками.
, Більш інтенсивні системи смуг позначені більш жирними стрілками.
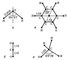
Мал. 2. Рівноважні конфігурації молекул: а - H2O; б - CO2; в - C6H6; г - CH4. Числами вказані довжини зв'язків (в  ) І величини валентних кутів.
) І величини валентних кутів.

Мал. 3. Електронно-коливальний спектр молекули N2 у близькій ультрафіолетової області; групи смуг відповідають різним значенням D v = v '- v' '.


 С сентября 2006 года серийно выпускается БМВ 3-й серии купе (Е92). Невзирая на свое техническое родство с седаном и Touring, купе БМВ 3-й серии имеет
С сентября 2006 года серийно выпускается БМВ 3-й серии купе (Е92). Невзирая на свое техническое родство с седаном и Touring, купе БМВ 3-й серии имеет
 Аш длительный тест Range Rover Sport Supercharged подошел к концу. Первая хорошая новость: машину не угнали! Вторая: несмотря на соблазн, за
Аш длительный тест Range Rover Sport Supercharged подошел к концу. Первая хорошая новость: машину не угнали! Вторая: несмотря на соблазн, за
 Audi E-tron, представленный на автосалоне в Детройте в январе 2010 года, совсем не то же самое, что E-tron, который выставлялся осенью на IAA 2009 во
Audi E-tron, представленный на автосалоне в Детройте в январе 2010 года, совсем не то же самое, что E-tron, который выставлялся осенью на IAA 2009 во
 В зимнее время года при морозной погоде аккумулятор автомобиля испытывает нагрузку намного больше, чем в летнее время. Автовладельцами замеченны
В зимнее время года при морозной погоде аккумулятор автомобиля испытывает нагрузку намного больше, чем в летнее время. Автовладельцами замеченны
 Эта модель расширяет присутствие компании SEAT в сегменте рынка престижных автомобилей. Toledo - первый автомобиль компании дизайн которого выполнен
Эта модель расширяет присутствие компании SEAT в сегменте рынка престижных автомобилей. Toledo - первый автомобиль компании дизайн которого выполнен
 В 2000 г. семейство японских Corolla лишь обновилось. Спрос на эти машины падал и классическая Corolla уже не устраивала японских покупателей. Как
В 2000 г. семейство японских Corolla лишь обновилось. Спрос на эти машины падал и классическая Corolla уже не устраивала японских покупателей. Как
 Skoda Octavia - это современный переднеприводной автомобиль с поперечным расположением двигателя. На нём может стоять один из пяти моторов концерна
Skoda Octavia - это современный переднеприводной автомобиль с поперечным расположением двигателя. На нём может стоять один из пяти моторов концерна
 Дебют серийной модели PT Cruiser состоялся в 1999 году в Детройте. Компании Chrysler удалось зацепить ностальгическую струну в душе каждого простого
Дебют серийной модели PT Cruiser состоялся в 1999 году в Детройте. Компании Chrysler удалось зацепить ностальгическую струну в душе каждого простого
 Компания сыграла на контрасте, представив одновременно две модели, совершенно противоположные по идеологии: сверхэкономичный лимузин-гибрид А8 и
Компания сыграла на контрасте, представив одновременно две модели, совершенно противоположные по идеологии: сверхэкономичный лимузин-гибрид А8 и
 Toyota Tundra (Тойота Тундра) проектировался как грузовик. Мощный двигатель, основательная рама и большая грузоподъемность... вот что отличает этот
Toyota Tundra (Тойота Тундра) проектировался как грузовик. Мощный двигатель, основательная рама и большая грузоподъемность... вот что отличает этот

